Como funcionam?
Por que em alguns espectros as linhas são pretas e em outros as linhas são coloridas?
Com o tempo, as linhas escuras no espectro observado vão se tornando menos misteriosas. As investigações de Sir John Frederick William John Herschel e seu amigo William Henry Fox Talbot (o inventor da fotografia) mostraram que cada substância ao ser queimada e ter a luz de sua chama passada por um espectroscópio, apresentava linhas em diferentes comprimentos de onda no espectro visível. Alguns exemplos podem ser vistos a seguir.
Espectro de emissão do Hidrogênio. λemissão = 397 nm, 410 nm, 434 nm, 486 nm, 656 nm. Note que 1 nm = 1 × 10-9m.
Espectro de emissão do Carbono. Escala ×10-10m.
Em 1833, as experiências do professor de química William Allen Miller comprovaram que se a luz solar passasse através de vários gases no laboratório, apareceriam linhas escuras adicionais. Logo em seguida o físico francês Jean Bernard Léon Foucault identificou um par de linhas próximas escuras no espectro do Sol muito próximas à algumas linhas do espectro obtido através do aquecimento do Sódio em laboratório (figura abaixo). Não demorou para que os cientistas entrassem num consenso de que as linhas pretas existentes no espectro do Sol era devido à presença de alguns gases na superfície do mesmo.
Espectro de emissão do Sódio. Escala ×10-10m.
O cientista escocês Balfour Stewart, e o alemão Gustav Robert Kirchhoff independentemente um do outro demonstraram que, se um corpo emitia radiação em um comprimento de onda específico, então também absorvia melhor a radiação incidente nesses mesmos comprimentos de onda. Ao final de 1860 Kirchhoff, depois de muitos estudos, havia verificado que um gás ou sólido incandescente, sob alta pressão, produz um espectro contínuo, ao contrário de um gás incandescente sob baixa pressão (rarefeito) que produz linhas características desse gás, assim como a radiação contínua que passa pelo mesmo gás rarefeito, mas agora frio, produzirá linhas escuras no espectro, exatamente nos mesmos comprimentos de onda que ele emite quando incandescente (veja ilustração abaixo).
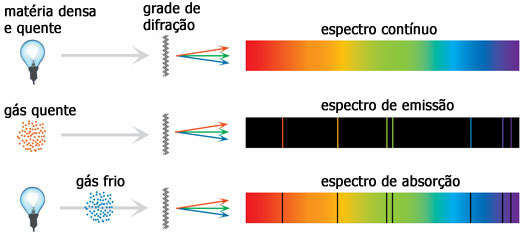
Linhas de emissão e absorção de um gás. Note que na parte superior da figura, é representado o espectro de emissão de um material quente e denso. Na parte do meio, o gás, agora rarefeito, emite em determinados comprimentos de onda característicos do material. E na parte de baixo, quando uma luz emitida num espectro contínuo passa por um gás rarefeito e frio, este gás acaba por absorver parte da radiação em determinados comprimentos de onda (os mesmos nos quais ele emitiria radiação se estivesse quente).
Porque as linhas são assim já sabemos, mas elas seriam aleatórias? Continue para saber mais...
